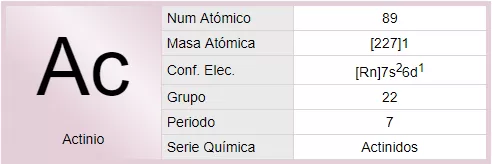
El actinio es un elemento químico de símbolo Ac y número atómico 89, perteneciente al grupo IIIB, periodo 7 y bloque F de la tabla periódica de los elementos.Es una de las tierras raras y da nombre a una de las series, la de los actínidos.Es un metal radiactivo blando que reluce en la oscuridad. Se conocen los isótopos con número másico entre 209 y 234, siendo el más estable el 227Ac que tiene una vida media de 21,7 años. El 227Ac se encuentra en el uranio natural en una proporción del orden del 0,175% y el 228Ac también se encuentra en la naturaleza.
Abundancia y obtención
Solo existe una corta lista de compuestos con actinio, por ejemplo AcF3, AcCl3, AcBr3, AcOF, AcOCl, AcOBr, Ac2S3, Ac2O3 y AcPO4. Todas esas moléculas tienen configuraciones muy similares a los compuestos correspondientes del lantano, por lo que se estima que en ellos el actino ocurre con un número de oxidación de +3.
Se encuentran trazas de actinio (227Ac) en minerales de uranio, pero comúnmente se obtienen pequeñas cantidades (del orden de miligramos) bombardeando 226Ra con neutrones en un reactor nuclear seguido de una desintegración β- del isotopo 227Ra resultante.
{\displaystyle \mathrm {^{226}_{\ 88}Ra\ +\ _{0}^{1}n\ \longrightarrow \ _{\ 88}^{227}Ra\ {\xrightarrow[{42,2\ min}]{\beta ^{-}}}\ _{\ 89}^{227}Ac} }
Los tiempos son de semivida.
Isótopos
Los isótopos radiactivos 227Ac son los únicos que se encuentran en la naturaleza y son los más estables de la treintena de isótopos identificados con un periodo de semidesintegración de 21,773 años, seguido del 225Ac (10 días),?226Ac (29,37 horas) y el 228Ac (6,13 horas). El resto de isótopos tienen periodos de semidesintegración inferiores a las 10 horas y la mayoría de ellos menores de un minuto.
El 227Ac alcanza el equilibrio con sus productos de desintegración transcurridos 185 días, transmutándose posteriormente con arreglo a un periodo de semidesintegración de 21,773 años.
Aplicaciones
El uso del actinio es casi exclusivo para investigaciones científicas. La radiactividad del actinio es del orden de 150 veces la del radio, haciéndolo útil como fuente de neutrones; al margen de ello, no tiene aplicaciones industriales significativas.
El francio, elemento 87 de la tabla periódica, es un metal alcalino radiactivo caracterizado en 1939, el cual se obtiene en pequeñas cantidades como resultado de un decaimiento específico del 227Ac en la serie radiactiva que tiene inicio con el 235U.
Ac 225
El 225Ac se emplea en medicina en la producción de Bi-213 utilizado en radioterapia. La combinación del isotopo 225Ac con el anticuerpo monoclonal lintuzumab forma un radioinmunoconjugado emisor de radiación alfa (abreviado «225Ac-HuM195») con posible actividad antineoplásica. La fracción correspondiente al anticuerpo monoclonal lintuzumab se une específicamente al antígeno de superficie celular CD33 y, con la presencia del actinio radiactivo entrega a la célula maligna una dosis de radiación alfa que resulta citotóxica para las células que expresan dicho antígeno celular, fundamentalmente las células madre hematopoyéticas normales no pluripotentes y resulta estar sobreexpresado en células de causantes de la leucemia mieloide. De la misma manera se combina el 213Bi — producido a partir del 225Ac mismo — al anticuerpo monoclonal con el mismo efecto radioinmune. El uso de ambos isótopos evita tener que usar emisores beta como se hacía en el pasado los cuales lesionaban a tejido sano circunvecino al tumor. La combinación con el 225Ac resulta tener mayor potencia debido a que tiene una vida media superior al 213Bi.
Precauciones
El 227Ac es extremadamente radiactivo y, teniendo en cuenta sus potenciales efectos sobre la salud, es tan peligroso como el plutonio. La ingesta, incluso en pequeñas cantidades, puede causar daños muy graves.
![{\displaystyle \mathrm {^{226}_{\ 88}Ra\ +\ _{0}^{1}n\ \longrightarrow \ _{\ 88}^{227}Ra\ {\xrightarrow[{42,2\ min}]{\beta ^{-}}}\ _{\ 89}^{227}Ac} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/c9ead92b5741b8d2dc958c429e610f57b59c0d95)