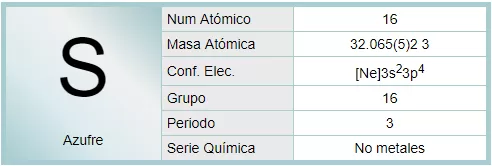
El azufre es un elemento químico de número atómico 16 y símbolo S. Es un no metal abundante con un color amarillo característico
El azufre se encuentra en forma nativa en regiones volcánicas y en sus formas reducidas formando sulfuros y sulfosales o bien en sus formas oxidadas como sulfatos. Es un elemento químico esencial constituyente de los aminoácidos cisteina y metionina y, por consiguiente, necesario para la síntesis de proteínas presentes en todos los organismos vivos. Se usa principalmente como fertilizante pero también en la fabricación de pólvora, laxantes, fósforos e insecticidas.
Abundancia y obtención
El azufre es un elemento muy abundante en la corteza terrestre, se encuentra en grandes cantidades combinado en forma de sulfuros (pirita, galena) y de sulfatos (yeso). En forma nativa se encuentra en las cercanías de aguas termales, zonas volcánicas y en minas de cinabrio, galena, esfalerita y estibina, y en Luisiana (Estados Unidos, primer productor mundial) se extrae mediante el proceso Frasch consistente en inyectar vapor de agua sobrecalentado para fundir el azufre que posteriormente es bombeado al exterior utilizando aire comprimido.
También está presente, en pequeñas cantidades, en combustibles fósiles (carbón y petróleo) cuya combustión produce dióxido de azufre que combinado con agua produce la lluvia ácida.
Isótopos
Se conocen 25 isótopos del azufre, de los cuales cuatro son estables: S-32 (95,02 %), S-33 (0,75 %), S-34 (4,21 %) y S-36 (0,025 %). Aparte del S-35, formado al incidir la radiación cósmica sobre el argón-40 atmosférico y que tiene un periodo de semidesintegración de 87 días, los demás isótopos radiactivos son de vida corta.
Aplicaciones
El azufre se usa en multitud de procesos industriales, como la producción de ácido sulfúrico para baterías, la fabricación de pólvora y el vulcanizado del caucho.
Los sulfitos se usan para blanquear el papel y en fósforos. El tiosulfato de sodio o amonio se emplea en la industria fotográfica como «fijador» ya que disuelve el bromuro de plata; y el sulfato de magnesio (sal de Epsom) tiene usos diversos como laxante, exfoliante, o suplemento nutritivo para plantas.
También el azufre se emplea en la industria enologica como antiseptico, en uno de sus principales usos como Anhidrido Sulfuroso.
El azufre tiene usos como fungicida y en la manufactura de fosfatos fertilizantes.
Precauciones
El disulfuro de carbono, el sulfuro de hidrógeno (sulfhídrico), y el dióxido de azufre deben manejarse con precaución.
El sulfhídrico y algunos de sus derivados, los mercaptanos, son bastante tóxicos (más que el cianuro). Aunque muy maloliente incluso en concentraciones bajas, cuando la concentración se incrementa el sentido del olfato rápidamente se satura o se narcotiza desapareciendo el olor por lo que a las víctimas potenciales de la exposición les puede pasar desapercibida su presencia en el aire hasta que se manifiestan sus efectos, posiblemente mortales.
El dióxido de azufre reacciona con el agua atmosférica para producir la lluvia ácida. Irrita las mucosidades y los ojos y provoca tos al ser inhalado.
Los vapores del ácido sulfúrico pueden provocar hemorragias en los pulmones, llenándolos de sangre con la consiguiente asfixia.