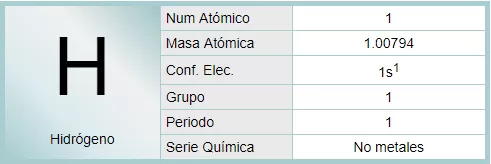
El hidrógeno es el elemento químico de número atómico 1, representado por el símbolo H. Con una masa atómica de 1,00794 (7) u, es el más ligero de la tabla de los elementos. Por lo general, se presenta en su forma molecular, formando el gas diatómico H2 en condiciones normales. Este gas es inflamable, incoloro, inodoro, no metálico e insoluble en agua.
Debido a sus distintas propiedades, el hidrógeno no se puede encuadrar claramente en ningún grupo de la tabla periódica, aunque muchas veces se sitúa en el grupo 1 (o familia 1A) por poseer un solo electrón en la capa de valencia o capa superior.
El hidrógeno es el elemento químico más abundante, al constituir aproximadamente el 75 % de la materia visible del universo. El hidrógeno elemental es relativamente raro en la Tierra y es producido industrialmente a partir de hidrocarburos como, por ejemplo, el metano. La mayor parte del hidrógeno elemental se obtiene in situ, es decir, en el lugar y en el momento en que se necesita. Los mayores mercados del mundo disfrutan de la utilización del hidrógeno para el mejoramiento de combustibles fósiles (en el proceso de hidrocraqueo) y en la producción de amoníaco (principalmente para el mercado de fertilizantes). El hidrógeno puede obtenerse a partir del agua por un proceso de electrólisis, pero resulta un método mucho más caro que la obtención a partir del gas natural.
El isótopo del hidrógeno más común es el protio, cuyo núcleo está formado por un único protón y ningún neutrón. En los compuestos iónicos, puede tener una carga positiva (convirtiéndose en un catión llamado hidrón, H+, compuesto únicamente por un protón, a veces en presencia de 1 o 2 neutrones); o carga negativa (convirtiéndose en un anión conocido como hidruro, H-). También se pueden formar otros isótopos, como el deuterio, con un neutrón, y el tritio, con dos neutrones.
Las características de este elemento y su solubilidad en diversos metales son muy importantes en la metalurgia, puesto que muchos metales pueden sufrir fragilidad en su presencia, y en el desarrollo de formas seguras de almacenarlo para su uso como combustible. Es altamente soluble en diversos compuestos que poseen tierras raras y metales de transición, y puede ser disuelto tanto en metales cristalinos como amorfos. La solubilidad del hidrógeno en los metales está influenciada por las distorsiones locales o impurezas en la estructura cristalina del metal.
Isótopos
El isótopo más común de hidrógeno no posee neutrones, existiendo otros dos, el deuterio (D) con uno y el tritio (T), radiactivo con dos. El deuterio tiene una abundancia natural comprendida entre 0,0184 y 0,0082 % (IUPAC). El hidrógeno es el único elemento químico que tiene nombres y símbolos químicos distintos para sus diferentes isótopos.
- 1H, conocido como protio, es el isótopo más común del hidrógeno con una abundancia de más del 99,98 %. Debido a que el núcleo de este isótopo está formado por un solo protón se le ha bautizado como protio, nombre que a pesar de ser muy descriptivo, es poco usado.
- ²H, el otro isótopo estable del hidrógeno, es conocido como deuterio y su núcleo contiene un protón y un neutrón. El deuterio representa el 0,0026 % o el 0,0184 % (según sea en fracción molar o fracción atómica) del hidrógeno presente en la Tierra, encontrándose las menores concentraciones en el hidrógeno gaseoso, y las mayores (0,015 % o 150 ppm) en aguas oceánicas. El deuterio no es radiactivo, y no representa un riesgo significativo de toxicidad. El agua enriquecida en moléculas que incluyen deuterio en lugar de hidrógeno 1H (protio), se denomina agua pesada. El deuterio y sus compuestos se emplean en marcado no radiactivo en experimentos y también en disolventes usados en espectroscopia 1H - RMN. El agua pesada se utiliza como moderador de neutrones y refrigerante en reactores nucleares. El deuterio es también un potencial combustible para la fusión nuclear con fines comerciales.
- ³H se conoce como tritio y contiene un protón y dos neutrones en su núcleo. Es radiactivo, desintegrándose en ³2He+ a través de una emisión beta.
Aplicaciones
Se necesitan grandes cantidades de H2 en las industrias del petróleo y química. Una aplicación adicional de H2 es de tratamiento ("mejoramiento") de combustibles fósiles, y en la producción de amoníaco. Los principales consumidores de H2 en una planta petroquímica incluyen hidrodesalquilación, hidrodesulfuración, y de hidrocraqueo. El H2 se utiliza como un agente hidrogenizante, particularmente en el aumento del nivel de saturación de las grasas y aceites insaturados (que se encuentran en artículos como la margarina) y en la producción de metanol. Del mismo modo es la fuente de hidrógeno en la fabricación de ácido clorhídrico. El H2 también se utiliza como agente reductor de minerales metálicos.
Además de su uso como un reactivo, H2 tiene amplias aplicaciones en la física y la ingeniería. Se utiliza como gas de protección en los métodos de soldadura tales como la soldadura de hidrógeno atómico. H2 se utiliza como un enfriador de generadores en centrales eléctricas, porque tiene la mayor conductividad térmica de todos los gases. H2líquido se utiliza en la investigaciones criogénicas, incluyendo estudios de superconductividad. Dado que el H2 es más ligero que el aire, teniendo un poco más de 1/15 de la densidad del aire, fue ampliamente utilizado en el pasado como gas de elevación en globos aerostáticos y dirigibles.