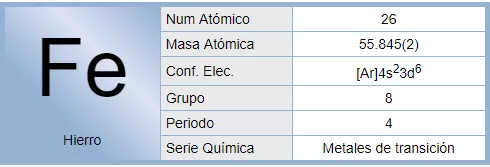
El hierro o fierro es un elemento químico de número atómico 26 situado en el grupo 8, periodo 4 de la tabla periódica de los elementos. Su símbolo es Fe y tiene una masa atómica de 55,6 u.
Este metal de transición es el cuarto elemento más abundante en la corteza terrestre, representando un 5 % y, entre los metales, solo el aluminio es más abundante; y es el primero más abundante en masa planetaria, debido a que el planeta en su núcleo, se concentra la mayor masa de hierro nativo equivalente a un 70 %. El núcleo de la Tierra está formado principalmente por hierro y níquel en forma metálica, generando al moverse un campo magnético.
Abundancia
El hierro es el metal de transición más abundante en la corteza terrestre, y cuarto de todos los elementos. También existe en el Universo, habiéndose encontrado meteoritos que lo contienen. Es el principal metal que compone el núcleo de la Tierra hasta con un 70 %. Se encuentra formando parte de numerosos minerales, entre los que destacan la hematites (Fe2O3), la magnetita (Fe3O4), la limonita (FeO (OH)), la siderita (FeCO3), la pirita (FeS2), la ilmenita (FeTiO3), etcétera.
Se puede obtener hierro a partir de los óxidos con más o menos impurezas. Muchos de los minerales de hierro son óxidos, y los que no, se pueden oxidar para obtener los correspondientes óxidos.
La reducción de los óxidos para obtener hierro se lleva a cabo en un horno denominado comúnmente alto horno. En él se añaden los minerales de hierro en presencia de coque y carbonato de calcio, CaCO3, que actúa como escorificante.
Isótopos
El hierro tiene cuatro isótopos estables naturales:?54Fe,?56Fe,?57Fe y 58Fe, Las abundancias relativas en las que se encuentran en la naturaleza son de aproximadamente: 54Fe (5,8 %),?56Fe (91,7 %),?57Fe (2,2 %) y 58Fe (0,3 %).
Aplicaciones
El hierro es el metal duro más usado, con el 95 % en peso de la producción mundial de metal. El hierro puro (pureza a partir de 99,5 %) no tiene demasiadas aplicaciones, salvo excepciones para utilizar su potencial magnético. El hierro tiene su gran aplicación para formar los productos siderúrgicos, utilizando éste como elemento matriz para alojar otros elementos aleantes tanto metálicos como no metálicos, que confieren distintas propiedades al material. Se considera que una aleación de hierro es acero si contiene menos de un 2,1 % de carbono; si el porcentaje es mayor, recibe el nombre de fundición.
El acero es indispensable debido a su bajo precio y tenacidad, especialmente en automóviles, barcos y componentes estructurales de edificios.
Las aleaciones férreas presentan una gran variedad de propiedades mecánicas dependiendo de su composición o el tratamiento que se haya llevado a cabo.
Precauciones
La siderosis es el depósito de hierro en los tejidos. El hierro en exceso es tóxico. El hierro reacciona con peróxido y produce radicales libres; la reacción más importante es:
Fe2+ + H2O2 → Fe3+ + OH- + OH•
Cuando el hierro se encuentra dentro de unos niveles normales, los mecanismos antioxidantes del organismo pueden controlar este proceso.
La dosis letal de hierro en un niño de 2 años es de unos 3.1 g puede provocar un envenenamiento importante. El hierro en exceso se acumula en el hígado y provoca daños en este órgano.