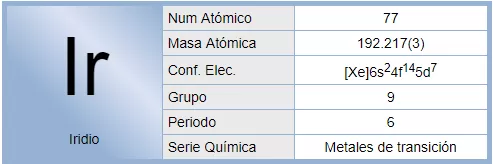
El iridio es un elemento químico de número atómico 77 que se sitúa en el grupo 9 de la tabla periódica. Su símbolo es Ir. Se trata de un metal de transición, del grupo del platino, duro, frágil, pesado, de color blanco plateado. Es el segundo elemento más denso (después del osmio) y es el elemento más resistente a la corrosión, incluso a temperaturas tan altas como 2000 °C. Solo algunos halógenos y sales fundidas son corrosivas para el iridio en estado sólido. El iridio en polvo es mucho más reactivo y puede llegar a ser inflamable.
Los compuestos de iridio más importantes son las sales y ácidos que forma junto con el cloro, aunque el iridio también forma una serie de compuestos organometálicos, utilizados en la catálisis industrial y en investigación. El iridio metálico es usado cuando se necesita alta resistencia a la corrosión a altas temperaturas, como en las bujías de gama alta, crisoles para la recristalización de los semiconductores a altas temperaturas, y los electrodos para la producción de cloro mediante el proceso de cloro-álcali. Los radioisótopos de iridio se usan en algunos generadores de radioisótopos.
Abundancia
El iridio es uno de los elementos menos abundantes en la corteza terrestre, en promedio solo se encuentra una fracción de masa de 0.001 ppm en toda la corteza; el oro es 40 veces más abundante, el platino 10 veces más, y la plata y el Mercurio unas 80 veces más abundantes que el iridio. El telurio es tan abundante como el iridio. Únicamente existen tres elementos tan poco abundantes como el iridio: el renio, el rutenio y el rodio; el iridio es 10 veces más abundante que los últimos dos. En contraste con su escasa abundancia en la corteza terrestre, el iridio es relativamente común en los meteoritos, con una concentración de 0,5 ppm o más.
El iridio se puede encontrar en la naturaleza como un elemento sin combinar o en aleaciones naturales, especialmente las aleaciones de osmio-iridio, estas aleaciones se pueden separar en dos grandes grupos: las aleaciones osmiridio, las cuales son más ricas en osmio, y las iridiosmio que contienen una mayor cantidad de iridio que de osmio. También se encuentra en los depósitos de níquel y cobre, normalmente se encuentran metales del grupo del platino en estos yacimientos en forma de sulfuros, telururos, antimoniuros, y arseniuros. Dentro de la corteza terrestre, el iridio se encuentra en concentraciones más altas en tres tipos de estructura geológica: los depósitos ígneos, los cráteres de impacto, y depósitos elaborados a partir de una de estas estructuras. La reserva primaria de iridio más grande conocida es la del complejo ígneo Bushveld en Sudáfrica, aunque los grandes depósitos de cobre-níquel cerca de Norilsk, en Rusia, y la cuenca de Sudbury en Canadá también son importantes fuentes de iridio. Pequeñas reservas de este metal también han sido encontradas en los Estados Unidos. El iridio puede encontrarse en depósitos secundarios, combinado con el platino u otros metales del grupo del platino en depósitos aluviales. Este tipo de depósitos fueron explotados por las culturas precolombinas en el departamento del chocó, aún hoy en día siguen siendo una fuente de metales del grupo del platino.
Isótopos
El iridio tiene dos isotopos naturales estables, el 191Ir y el 193Ir, con una abundancia natural de 37.3% y 62.7%, respectivamente. Al menos 34 radioisótopos han sido sintetizados variando entre números másicos de 164 a 199. El 192Ir, el cual se desintegra en los dos isótopos estables, es el radioisótopo más estable con una vida media de 73.827 días. Otros tres isótopos, el 188Ir, 189Ir, 190Ir, tienen una vida media de al menos un día. Isótopos con número de masa debajo de 191 decaen mediante una combinación de desintegración ß, desintegración α y emisión de protones, con la excepción del 189Ir, que decae por medio de captura electrónica, y el 190Ir, el cual decae por medio de emisión de positrones. Isótopos sintéticos con una masa atómica mayor a 191 decaen mediante desintegración β–, aunque el 192Ir también puede decaer en menor medida mediante captura de electrones. Todos los isotopos conocidos de iridio fueron descubiertos entre 1934 y 2001, el más reciente de ellos es el 171Ir.
Al menos 32 isómeros metaestables han sido caracterizados, variando en masa atómica entre 164 a 197, el más estable de todos estos es el 192m2Ir, el cual decae mediante transición isomérica con una vida media de 241 años, por lo que es más estable que cualquiera de los isótopos sintéticos de iridio en sus estados fundamentales. El menos estable es el 190m3Ir, con una vida media de apenas 2 µs. El isótopo 191Ir fue el primer elemento en que se vio el efecto Mößbauer, lo que lo hace útil para la espectroscopia Mössbauer en investigaciones físicas, químicas, bioquímicas, metalúrgicas y mineralogicas.
Aplicaciones
El alto punto de fusión, la dureza y resistencia a la corrosión del iridio y sus aleaciones determinan la mayoría de sus aplicaciones. El iridio y especialmente las aleaciones iridio-platino u osmio-iridio tienden a desgastarse muy poco y son usadas, por ejemplo, en múltiples hileras de poros, a través de las cuales un plástico fundido se extruye para formar fibras, como el rayón. Las aleaciones de osmio-iridio son usadas en brújulas y balanzas.
La resistencia a la corrosión y al calor hacen del iridio un agente de aleación importante. Algunas piezas de larga duración en motores de avión están hechas de iridio aleado y en tuberías para aguas profundas se usa una aleación especial de titanio-iridio debido a su resistencia a la corrosión.
El iridio también se emplea en aleaciones de alta resistencia que pueden soportar altas temperaturas.
Precauciones
El iridio en forma de metal no es peligroso para la salud debido a su poca reactividad con los tejidos, únicamente hay 20 partes por trillón de iridio en los tejidos humanos. Sin embargo, el polvo finamente dividido de iridio puede ser peligroso de manejar, ya que es irritante y puede inflamarse en el aire. Se sabe muy poco acerca de la toxicidad de los compuestos de iridio debido a la escasez del metal y a que sus compuestos se utilizan en cantidades muy pequeñas, pero las sales solubles, tales como los haluros de iridio, podrían ser peligrosos debido a los otros elementos que hacen parte del compuesto. Sin embargo, la gran mayoría de los compuestos de iridio son insolubles, lo que hace que la absorción involuntaria de estos compuestos por el cuerpo humano sea difícil. Un radioisótopo de iridio, el 192Ir, es peligroso al igual que cualquier otro isótopo radioactivo. Los únicos reportes relacionados con lesiones por iridio conciernen a la exposición accidental de 192Ir usado en braquiterapia. Las altas radiaciones de rayos gamma de alta energía por el 192Ir pueden incrementar el riesgo de cáncer. La exposición externa puede causar quemaduras, envenenamiento por radiación, y la muerte. La ingestión de 192Ir puede quemar el revestimiento del estómago y de los intestinos. 192Ir, 192mIr y 194mIr tienden a depositarse en el hígado, y puede plantear riesgos para la salud tanto por radiación gamma como por radiación beta